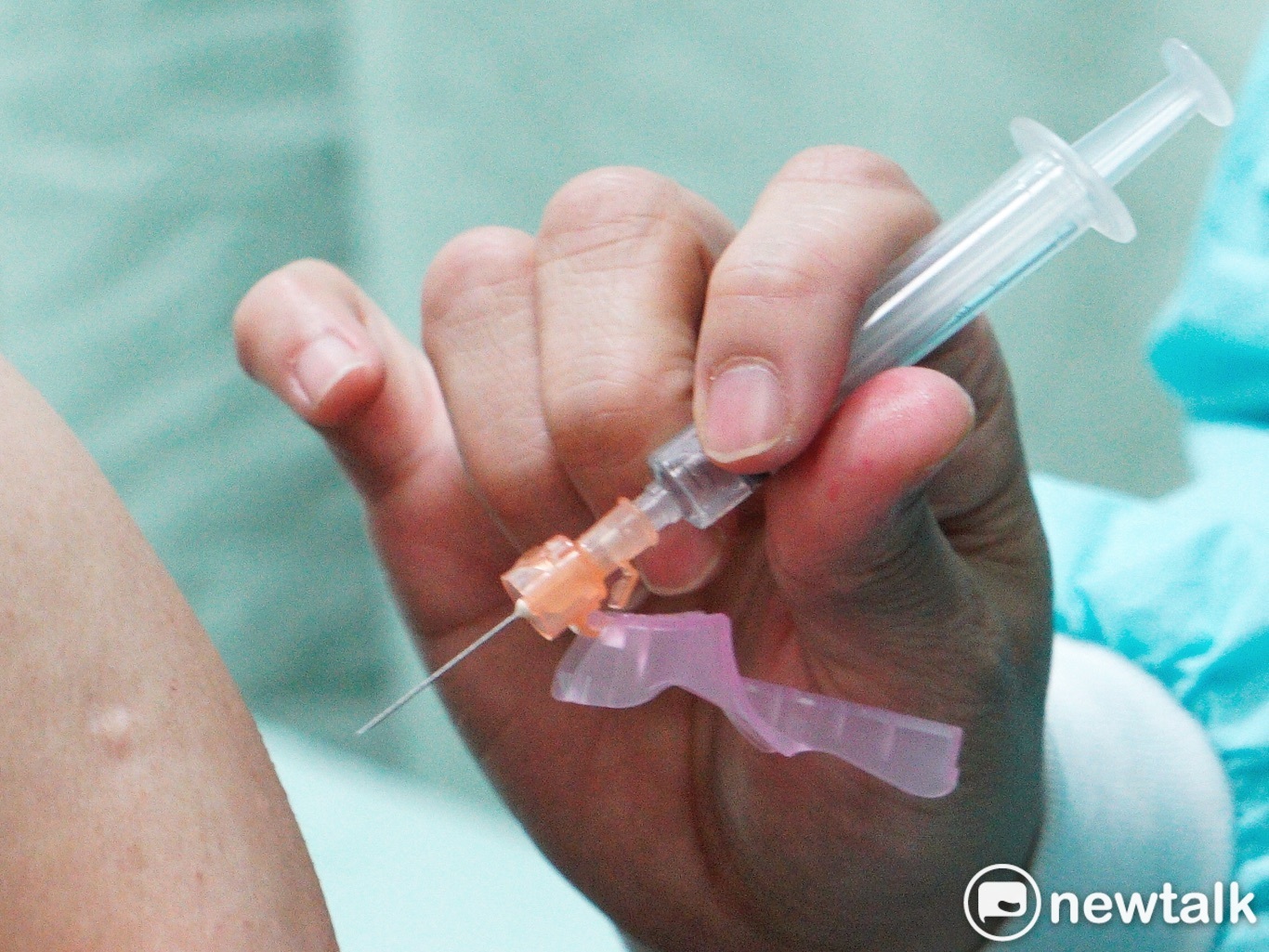
疫苗接种示意图。 图:张良一 / 摄(资料照)
美国疾管局 (CDC) 今 (24) 日宣布,65岁以上及高风险者,可打第 3 剂加强针,不过美国食品药物管理局 (FDA) 表示,辉瑞 (BNT) 疫苗加强针不适合与莫德纳或娇生疫苗混打。
美国联邦卫生部门一位高级官员表示,辉瑞公司的 COVID-19(新冠肺炎)增强剂疫苗,不应该给那些此前曾接种过莫德纳(Moderna)或娇生(Johnson & Johnson)公司疫苗的人使用。美国食品和药物管理局(Food and Drug Administration, FDA)疫苗监管部门的副主任多兰‧芬克(Doran Fink)22 日召开的疾病控制与预防中心免疫实践顾问委员会(CDC’s Advisory Committee on Immunization Practices)会议上说,没有数据表明,一种疫苗的加强剂,能够与另一种疫苗的初级系列疫苗具有可互换性。
芬克在美国疾病控制与预防中心(Centers for Disease Control and Prevention, CDC)的疫苗顾问小组会议上做出了上述评估,拟决定该机构是否应该向公众推荐辉瑞公司的加强剂疫苗。
而 FDA 于 22 日批准,授权为 65 岁及 65 岁以上的个人,以及那些面临高风险的人士接种辉瑞 COVID-19 加强剂疫苗,以对抗 Delta 变种病毒。此前,一个顾问小组在上週以压倒性多数票反对向公众推荐使用辉瑞第 3 剂(加强剂)疫苗。
同时,FDA表示,还需要更多的时间来审查,是否还需要批准娇生和 Moderna 公司的加强剂疫苗。FDA 代理局长珍妮特‧伍德科克(Janet Woodcock)在会议上说,在考虑了现有的全部科学证据,以及独立外部专家顾问委员会的审议意见之后,FDA 修订了辉瑞—生物技术公司 COVID-19 疫苗的紧急使用授权(EUA),允许某些人群,如医护人员、教师和日托工作人员、食品杂货店工作人员、无家可归者收容所或监狱的工作人员,以及其他人接种辉瑞加强剂疫苗。
此前推出单剂量疫苗的娇生公司本週表示,第二剂疫苗将使其在美国对抗 COVID-19 的疗效提高到 94%。娇生公司的疫苗使用腺病毒载体(adenovirus)技术,而 Moderna 和辉瑞公司则使用信使核糖核酸(mRNA)技术。
Moderna 公司说,也已经提出申请,寻求批准销售其增强剂疫苗。然而,FDA 并未提供何时将就此做出决定的时间表。芬克在 22 日表示,他的部门正在儘快处理该公司的申请。
上週 FDA 顾问小组会议上,一些专家担心,接种辉瑞公司的第 3 剂疫苗,可能会导致严重的副作用,包括在年轻的接种者人中出现心肌炎症状。而雪城大学(Syracuse University)的流行病学家布列塔尼‧克穆什(Brittany Kmush)谈到,辉瑞公司引用以色列的一项研究声称,美国需要增强剂疫苗时需要注意的是 12 天的随访期和该研究做出的评估的可变性。他说,他不认为现在有足够的、高质量的数据,来就该问题做出明智的决定。
对此,美国 FDA 顾问小组的投票成员詹姆斯‧希尔德雷思博士(Dr. James Hildreth)补充表示,他对年轻人(接种疫苗后)的心肌炎症状非常关注。
另外,管理局的疫苗研究和审查官员 Joohee Lee 在审议会上表示,疫苗增强剂引发的不良反应与第 2 剂相当。她介绍说, 辉瑞药业公司对于 289 位年龄介于 18 岁至 55 岁的增强剂接种者的测试发现, 63.8% 的接种者接种疫苗后觉得疲倦,48.4% 的接种者出现头痛状态, 39.1% 接种者体接种后肌肉痛。
而管理局对于 2,682 位辉瑞第 2 剂疫苗接种者的观察发现, 61.5 % 的接种者出现疲倦现象,54 % 出现头痛状态,39.3 % 出现肌肉痛。而增强剂接种者发生淋巴结肿胀这种不良现象的比例为 5.2 %, 但是在接种第 2 剂时只有 0.4 %。她说,虽然大多数肿胀现象都很轻微或是中度的,而且最后都会消失,只有一个人的淋巴肿胀是持续的。
手机 App 已上线
点我下载