手机 App 已上线
点我下载
今天(11月20日),辉瑞公司(Pfizer)又传来好消息。该公司称,正在请求美国监管机构批准其COVID-19疫苗的紧急使用权。若是开启批准程序的话,最快在下个月就可能带来有限的首批疫苗。但是,想要靠疫苗结束新冠大流行的话,还得经历一个漫长而艰难的冬季。


图源:路透社
几天前,辉瑞公司和其德国合作伙伴BioNTech宣布,在一项正在进行的大型试验中,其疫苗的有效率高达95%,可以有效预防轻度至重度的COVID-19疾病。
辉瑞的疫苗也是加拿大订购的7种疫苗中的一款。
辉瑞公司表示,保护效果和良好的安全记录意味着其疫苗应该符合授权紧急使用的条件。这是美国食品药品管理局(FDA)在最终试验全部完成之前,可以给予的权利。
除了今天向FDA提交申请外,辉瑞公司还在欧洲、英国和加拿大轮流开启申请,打算尽快提交类似信息。
辉瑞公司首席执行官Albert Bourla在一份声明中说:“为了提供安全有效的疫苗,我们的工作从未如此紧迫。”
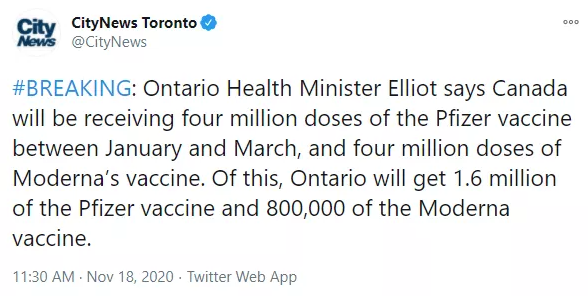
目前,加拿大将会在明年1月至3月间,收到400万支辉瑞疫苗和400万支莫德纳疫苗,共计800万支疫苗!其中,安省将会获得160万支辉瑞疫苗和80万支莫德纳疫苗,共计240万支COVID-19疫苗。此后,还会收到更多疫苗。
随着新冠病毒在美国和世界各地的兴起,监管机构面临迅速做出决策的压力。
美国顶尖的传染病专家福西(Dr. Anthony Fauci)说:“援助(疫苗)已经在路上。但是想要放弃口罩和其他防护措施,还为时过早。在援助到来之前,我们实际上需要加倍采取公共卫生措施。”
今天的申请消息引发了一系列事件,FDA和其独立顾问团队讨论是否已经准备好接种疫苗。如果是这样的话,还有另外一个政府团队将会决定如何将最初有限的疫苗,分配给那些焦急等待的美国人。
有多少疫苗可用,何时转移目标,最初的供应将会是稀缺有限的,定量分配的。根据本周向美国国家医学科学院提供的信息,大约有2500万支辉瑞疫苗将在12月上市,1月有3000万支,2月和3月再有3500万支。为了产生免疫效果,接种疫苗者需要接种2次,相隔3周。
辉瑞的竞争对手,莫德纳公司的COVID-19疫苗紧随其后。该公司的早期试验数据表明,其疫苗与辉瑞疫苗一样强大,也希望能在数周内寻求紧急使用授权。
公众第一次见证辉瑞的有力证据,将会是在12月初由FDA科学顾问团队举行的公开会议上。
到目前为止,大家已知的信息仅限于辉瑞和BioNTech的声明。在检测到的170例感染中,只有8例接种了真实的疫苗,其余的都是接种了安慰剂。
在安全方面,38000名疫苗试验参与者,在接种完第二次之后,已经被追踪了2个月。“2个月”是FDA设置的时间点,因为从历史数据来看,疫苗的副作用不会更晚出现。
费城儿童医院的FDA顾问Dr. Paul Offit说:“我们将会深入研究这些数据。”
在公开会议之前,FDA会发布自己的内部分析,这是为顾问团队的全天讨论搭建基础。在作出裁决之前,问题将会围绕安全问题的任何迹象,和新疫苗技术的效果。
顾问团队将会建议FDA是否应该允许疫苗的广泛使用,还会建议疫苗给谁使用。例如,是否有足够的证据显示,疫苗不仅能对年轻人和健康的人有效,也能对老年人和重病成年人有效。
目前,仍然没有任何保证。FDA前首席疫苗官Norman Baylor说:“我们不知道这场讨论会的最终投票结果会是怎样的。”
