当mRNA疫苗被注射器推进人体后,
身体内的“谍中谍”大戏便随后上演——
伪装信使、潜入军营,
发号施令、排兵布阵,
进行紧锣密鼓的抗病毒“演习”

体外RNA之所以能顺利“潜入”人体,
关键是科学家们发现了绝佳的
“RNA整容术”——碱基修饰,
这也正是今年诺贝尔生理学或医学奖的颁奖对象!
传统新冠疫苗:原来不是我
mRNA:难道是我?
碱基修饰:都坐下,让你们看看谁才是大佬!
从出现第一例确诊病例,
到第一例人体实验,
67天,
这是人类研制疫苗的最快速度。
当时针拨回到2019年。这一年,新冠疫情暴发,开启了一场关乎全球人类健康的抗疫长跑。在人类与新冠病毒的较量中,助力人类在较短时间内便取得胜利的大“功臣”,无疑是mRNA疫苗的快速研发和普及。
资料显示,第一个新冠确诊病例出现过去仅仅67天,mRNA疫苗就进行了第一例人体试验。
这样里程碑式的突破,与两位科学家——匈牙利生物化学家卡塔琳·卡里科和美国免疫学家德鲁·韦斯曼的研究密不可分。他们也因此荣获2023年诺贝尔生理学或医学奖。

两位科学家获2023年诺贝尔生理学或医学奖
先养牛再喝奶?
不,真不一定
传统疫苗和mRNA疫苗最大的区别:
传统疫苗=先养牛后产奶
mRNA疫苗=无中生“奶”
意思就是:假如我们要喝牛奶,传统疫苗就像是养一群奶牛进行供奶,而mRNA疫苗就类似于通过某种手段,直接让人本身(暂时)获得自己产奶的能力。
其实对于传统疫苗,我们可以简单粗暴地理解为就是“病毒”(类型包括灭活或弱化的病毒,以及部分病毒成分)。
注射疫苗就是给人体内注射病毒的“残兵败将”,先小强度地刺激免疫系统,让免疫系统“记住”病毒的“马甲”(病毒的蛋白质外壳),先进行一场抗病毒“演练”,日后遇上真病原体时就能迅速反应、群起攻之。(这也就解释了为什么部分人群在注射疫苗后会有些不良反应,可能是免疫系统比较弱,连残兵也没能招架住……)

但这种疫苗存在一个问题:因为病毒是要依赖活细胞才能存活的,我们要想制备大量的病毒疫苗,就得先培养大规模的细胞(养牛的过程)。
过程相当麻烦,成本也很高,最主要的问题是——慢!
所以,新一代疫苗彻底改变了思路——不再体外培养病毒了,直接导入生产病毒的“马甲”的指令,让身体自主制造。
病毒“马甲”,和其他蛋白质一样,都是在DNA(大老板)的总指挥下,借助各类“信使”(传话的),将生产指令(我要你生产什么样的蛋白质)传递给“蛋白质工厂”(核糖体),从而生产出各种特定蛋白质。
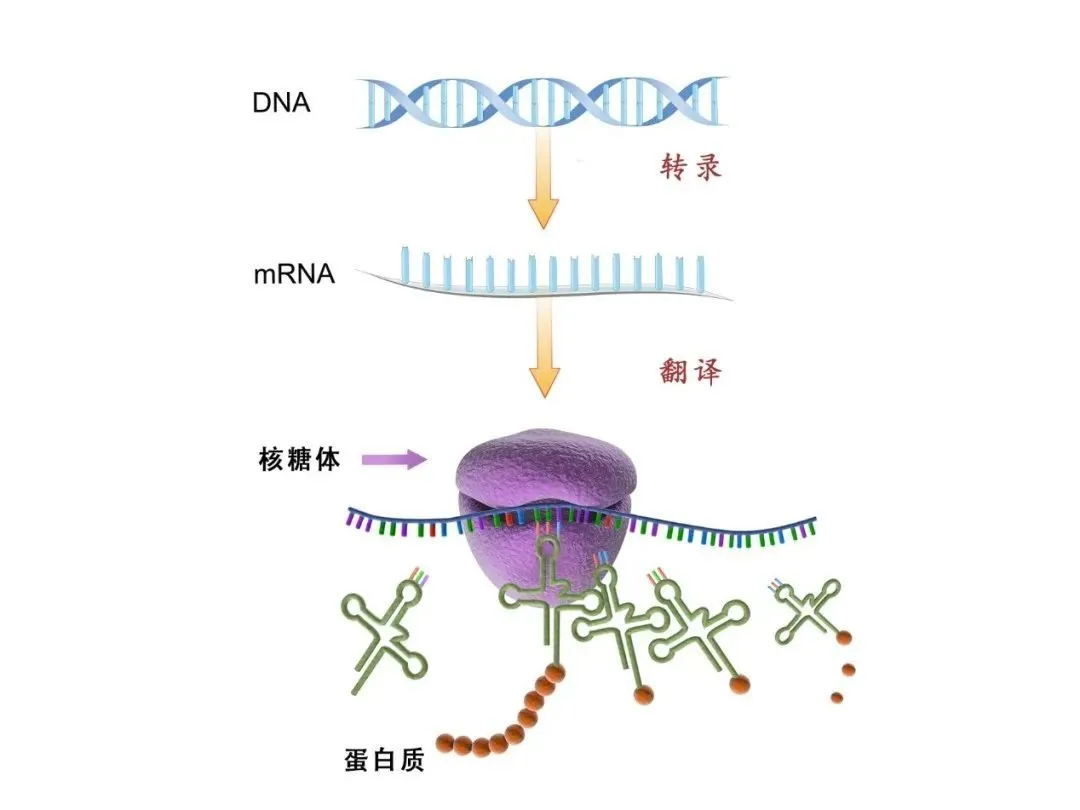
蛋白质生产流程图
这个“信使”,也就是我们今天的主角——mRNA(学名为信使核糖核酸)。
上世纪八十年代,科学家们就发明了体外生成mRNA的方法。体外生成的“人工信使”能按照科学家预期,携带特定的蛋白质生产指令。
所以只需要给身体提供这些“信使”,体内的“蛋白质工厂”就能根据指令,生产出大量的病毒“马甲”。(产奶的能力就这样来的)。
但其实,这还不是最终版的mRNA疫苗,科学家们在实验中又发现了问题。
身体防御心高气傲
体外RNA生死难料
这种“人工信使”,是科学家们制造出来的,是体外RNA,想要进入人体细胞,还需要面临两重关卡。
首先是RNA酶。它存在于人体的血液、汗水和眼泪中,可以迅速分解入侵人体细胞的任何 RNA。
其次是人体的免疫系统。即使“人工信使”能突破RNA酶这道防线,也会被灵敏的免疫系统发现并认定为“敌军”,导致它还没来得及生产蛋白质,就会被免疫系统团灭。

惹怒了免疫系统当然没有好果子吃,身体会出现很多炎症反应,这样的“人工信使”绝对是不合格的。
谍战大戏“伪装者”
人工信使“扮靓靓”
既然灵敏的免疫系统会排斥“人工信使”,那要是把它乔装打扮一下,使其更接近体内“信使”的样子,是不是就能逃过免疫系统的“追杀”了?
两位获奖的科学家就是这么做的。
他们通过对mRNA进行碱基修饰,成功将“人工信使”整容成体内“信使”,让mRNA可以躲避免疫系统的攻击,因此被误伤的mRNA数目大大减少。待mRNA成功潜入,接近“蛋白质工厂”,传递“指令”后,就能在体内生产大量病毒“马甲”。

后来,两位科学家又证明碱基修饰后的mRNA还会变得更加稳定,可以在蛋白翻译生产线上工作更长时间,产生更多蛋白质,从而被免疫系统更好“记住”。
总结来说,两位科学家的研究揭示了碱基修饰既能减少免疫反应,又能增加蛋白质产量,消除了mRNA疫苗临床应用道路上的关键障碍。
癌症疫苗,mRNA初心不变
我是RNA科学家,
我可以用mRNA造出一切。
——卡塔琳·卡里科
目前,mRNA疫苗正在以惊人的速度发展。
除了多种新冠mRNA疫苗之外,针对狂犬病、寨卡病毒、埃博拉等传染病,以及癌症、自身免疫病、罕见遗传病的mRNA疫苗也正在研发之中。

图片来源:视觉中国
其中,“癌症疫苗”疗法是mRNA技术最受关注的一个领域。
“癌症疫苗”的总体思路是让一个人的免疫系统可以精准区分肿瘤细胞和正常细胞,通过将肿瘤抗原以多种形式(如核酸、蛋白多肽等)导入患者体内,来刺激患者体内自身免疫系统的反应从而对肿瘤细胞进行清除。
由于不同癌症患者的肿瘤细胞突变不同,所以癌症疫苗一般是个性化定制的,需要对个体的肿瘤细胞进行基因测序以识别靶标,这种靶标通常是肿瘤细胞中出现的突变蛋白。

使用mRNA技术来定制癌症疫苗的一大优势在于: 一旦确定了这些靶标,就可以快速且相对便宜地生产癌症疫苗,疫苗价格还可能会下降。
mRNA疗法一步步地走进了现实,目前亟待解决的是靶向性问题——如果我们能够设法将药物递送到特定的器官或组织,比如大脑或者骨髓,那么mRNA 技术的用途将会更广。
未来,mRNA疫苗、药物和相关疗法会有怎样的长足发展?又会给深受疾病困扰的病友们带来怎样的好消息?
我们拭目以待。
















